
2310 اسیدیته * # (28)
2310 A. مقدمه
اسیدیته آب ظرفیت کمی آن برای واکنش با یک باز قوی در pH مشخص است. مقدار اندازه گیری شده ممکن است به طور قابل توجهی با pH نقطه پایانی مورد استفاده در تعیین، متفاوت باشد. اسیدیته اندازه گیری یک ویژگی جامع آب است و می تواند در مورد مواد خاص تنها زمانی که ترکیب شیمیایی نمونه شناخته شده است، تفسیر شود. اسیدهای معدنی قوی، اسیدهای ضعیف مانند کربنیک و استیک و نمک های هیدرولیز مانند آهن و سولفاتهای آلومینیوم با توجه به روش تعیین ممکن است به اندازه گیری اسیدیته کمک کنند.
اسیدها باعث خوردگی شده و بر سرعت واکنش های شیمیایی، شکل گیری شیمیایی و فرآیندهای بیولوژیکی تاثیر گذار هستند. اندازه گیری pH همچنین یکی از پارامترهای نشان دهنده تغییر در کیفیت آب منابع است.
2310 B. روش تیتراسیون
بحث عمومی
الف) اصول: یونهای هیدروژن موجود در یک نمونه حاصل از جداسازی یا هیدرولیز حل شونده، با افزودن محلول بازی استاندارد واکنش نشان می دهند. بنابراین اسیدیته به pH نقطه پایانی یا شناساگر مورد استفاده بستگی دارد. رسم یک منحنی تیتراسیون با ثبت PH نمونه پس از افزودن مقادیر اندازه گیری شده کوچک پی در پی از تیترکننده، اجازه می دهد شناسایی نقاط منحنی و ظرفیت بافر در صورت وجود و اسیدیته با توجه به pH مورد نظر تعیین شود.
در تیتراسیون یک گونه اسیدی تک ظرفیتی، مانند استاندارد سازی واکنشگرها، دقیق ترین نقطه پایانی از نقطه عطف منحنی تیتراسیون بدست می آید. نقطه عطف pHی است که در آن منحنی از محدب به مقعر یا برعکس تغییر می کند.
از آنجا که شناسایی دقیق نقاط عطف در مخلوط های بافر یا پیچیده ممکن است دشوار یا غیرممکن باشد، تیتراسیون در چنین مواردی بر اساس سنجش های عملی به یک نقطه پایانی قراردادی منتقل می شود. برای تیتراسیون های کنترلی معمول یا ارزیابی اولیه اسیدیته، تغییر رنگ یک شناساگر ممکن است برای نقطه پایانی استفاده شود. نمونه های پساب های صنعتی، زهاب اسیدی معدن یا محلول های دیگر که حاوی مقادیر قابل توجهی از یون های فلزی قابل هیدرولیز شدن مانند آهن، آلومینیوم و یا منگنز هستند برای اطمینان از اکسیداسیون همه ی گونه های اسیدی کاهش یافته از کاتیون های چند ظرفیتی با پراکسید هیدروژن پالایش شده و برای افزایش هیدرولیز جوشانده می شوند. اگر این روش دقیقا دنبال نگردد، نتایج حاصل از اندازه گیری اسیدیته می تواند بسیار متغیر باشد.
ب) نقاط پایانی: به طور ایده آل، نقطه پایانی تیتراسیون اسیدی باید با نقطه هم ارزی استوکیومتری برای خنثی سازی اسیدهای موجود منطبق باشد. pH در نقطه هم ارزی به نمونه، انتخاب بین نقاط عطف متعدد و استفاده مشخص از داده ها بستگی دارد.
دی اکسید کربن حل شده (CO2) معمولا جزء اصلی اسیدی آبهای سطحی غیر آلوده است. نمونه هایی از چنین منابعی را به دقت استفاده کنید تا گازهای حل شده از دست رفته به حداقل برسد. در یک نمونه حاوی کربن دی اکسید-بی کربنات ها-کربنات ها، تیتراسیون تا pH 8.3 در دمای 25 درجه سانتیگراد برابر با خنثی سازی استوکیومتری اسید کربنیک به بی کربنات می باشد. از آنجا که تغییر رنگ شناساگر فنولفتالین نزدیک به pH 8.3 است، این مقدار به طور کلی به عنوان نقطه پایانی استاندارد برای تیتراسیون اسیدیته کل، از جمله CO2 و اکثر اسید های ضعیف پذیرفته شده است. متاکرزول بنفش نیز دارای نقطه پایانی در pH 8.3 است و تغییر رنگ واضح تری را حاصل می کند.
برای ترکیبات پیچیده تر و یا محلول های بافر، انتخاب یک نقطه عطف ممکن است سلیقه ای باشد. در نتیجه، استفاده از نقطه پایانی ثابت در pH 3.7 و 8.3 جهت تعیین اسیدیته استاندارد توسط تیتراسیون پتانسیومتری در فاضلاب و آبهای طبیعی که در آن تعادل کربنات ساده مورد بحث قرار می گیرد،پذیرفته نیست. برومفنول آبی دارای تغییر رنگ شدید در نقطه پایانی 3.7 است. تیتراسیون های حاصل به طور عمومی به عنوان «اسیدیته متیل نارنجی» (pH 3.7) و «فنولفاتالین» یا اسیدیته کل (pH 8.3) بدون در نظر گرفتن روش عملی اندازه گیری شناخته می شوند.
پ) مزاحم ها: گازهای محلول مانند CO2، سولفید هیدروژن یا آمونیاک، که به اسیدیته یا قلیاییت کمک می کنند، ممکن است در طی نمونه برداری، ذخیره سازی یا تیتراسیون به محلول وارد شده یا از آن خارج شوند. چنین اثراتی را با انجام تیتراسیون تا رسیدن به نقطه پایانی سریعا بعد از باز کردن ظرف نمونه، اجتناب از تکان دادن و یا هم زدن شدید، حفاظت از نمونه از تماس با اتمسفر در طول تیتراسیون، و جلوگیری از گرم تر شدن نمونه نسبت به زمان نگهداری آن.
در تيتراسيون پتانسيومتري، ذرات چربي، جامدات معلق، رسوبات يا مواد زائد ديگر ميتوانند الکترود شیشه را پوشش دهند و در نتیجه باعث تاخیر در پاسخ شوند. اشکال این منبع خطا احتمالا در منحنی تیتراسیون نامنظم ظاهر می شود. مزاحم ها را از نمونه حذف نکنید زیرا ممکن است روی اسیدیته آن تاثیر بگذارند. با توقف های کوتاه حین افزودن تیترانت اجازه دهید الکترودها به تعادل برسند یا گاهی اوقات الکترودها را تمیز کنید.
در نمونه هایی که حاوی یون های اکسید شونده یا هیدرولیز شونده مانند آهن فروس و فریک، آلومینیوم و منگنز هستند، سرعت واکنش در دمای اتاق ممکن است به اندازه کافی آهسته باشد که باعث خطای نقطه پایانی شود.
از تیتراسیون شناساگر برای نمونه های رنگی یا کثیف که ممکن است تغییر رنگ در نقطه پایانی را پنهان کنند استفاده نکنید. کلر موجود اضافی در نمونه ممکن است شناساگر را سفید کند. این منبع تداخل با اضافه کردن 1 قطره تری سولفات سدیم (Na2S2O3) 0.1M از بین می رود.
ت) انتخاب روش: اسیدیته نمونه را از روی حجم باز استاندارد استفاده شده جهت تیتراسیون محلول تا pH 8.3 (اسیدیته فنولفتالئین) و یا pH 3.7 (اسیدیته متیل نارنجی برای فاضلاب و آب بسیار آلودگی) تعیین کنید. با استفاده از یک PH متر که به درستی کالیبره شده، تیترشونده الکتریکی یا شناساگر رنگی، در دمای اتاق تیتر کنید.
از فرایند پراکسید گرم (4A) برای پیش تصفیه نمونه های دارای (یا مشکوک به داشتن) یونهای فلزی قابل هیدرولیز شدن یا فرم های کاهش یافته ی کاتیون های چند ظرفیتی مانند مایعات اسیدشویی آهن، زهاب اسیدی معدن و سایر پساب های صنعتی است، استفاده کنید.
شناساگرهای رنگی ممکن است برای تیتراسیون های روزمره و کنترلی در غیاب مزاحمت رنگ و کدورت و برای تیتراسیون های اولیه برای انتخاب اندازه نمونه و قدرت تیترانت (¶4b) استفاده شود.
ث) اندازه نمونه: طیف اسیدیته های موجود در فاضلاب به قدری وسیع است که مقدار حجم و نرمالیته ی باز مورد استفاده به عنوان تیترانت قابل تعیین نمی باشد. برای دستیابی به دقت حجمی نسبتا خوب، از حجم زیادی از تیترانت (20 میلی لیتر یا بیشتر در یک بوروت 50 میلی لیتر) استفاده کنید، با این حال حجم نمونه را به اندازه کافی کوچک نگه دارید تا بتوانید نقاط پایانی تیزی به دست آورید.
برای نمونه هایی که دارای اسیدیته کمتر از 1000 میلی گرم بر حسب کلسیم کربنات بر لیتر (CaCO3) / L هستند، حجمی با اسیدیته معادل کمتر از 50 میلی گرم کلسیم کربنات را انتخاب کرده و با هیدروکسید سدیم (NaOH) 0.02 نرمال تیتر کنید. برای نمونه هایی با اسیدیته ی بیشتر از 1000 میلی گرم بر حسب CaCO3 / L، از محلولی حاوی اسیدیته معادل کمتر از 250 میلی گرم کلسیم کربنات استفاده کنید و با NaOH 0.1 نرمال تیتر کنید. در صورت لزوم، برای اندازه گیری حجم نمونه مطلوب و / یا نرمالیته ی تیترانت، تیتراسیون اولیه انجام دهید.
ج) نمونه برداری و ذخیره سازی: نمونه ها را در بطری های شیشه ای پلی اتیلن یا بورسیلیکات جمع آوری کرده و آنها را در دمای پایین نگه دارید. بطری ها را به طور کامل پر کنید و محکم ببندید. از آنجا که نمونه های فاضلاب ممکن است در معرض فرایندهای میکروبی قرار بگیرند و در معرض هوا CO2 یا سایر گازها از دست داده یا بگیرند، نمونه ها را بدون تاخیر، ترجیحا در عرض 1 دقيقه، آنالیز کنید. اگر فعالیت بیولوژیکی مد نظر شماست، در طی 6 ساعت آنالیز را انجام دهید. از تلاطم نمنه و قرار گرفتن طولانی مدت در معرض هوا اجتناب کنید.
دستگاه
الف) تیترکننده الکترومتریک: از هر pH سنج تجاری یا تیترکننده الکتریکی استفاده کنید که از یک الکترود شیشه ای استفاده می کند و می تواند تا دقت 0.05 واحد pH را بخواند. طبق دستورالعمل سازنده، استاندارد سازی و کالیبراسیون را انجام دهید. به شاخص دمایی و مراقبت الکترود توجه ویژه ای داشته باشید. اگر شاخص دمای اتوماتیک ارائه نشود، با دمای 25 ± 5 درجه سانتیگراد تیتر کنید.
ب) ظرف تیتراسیون: اندازه و فرم ظرف به الکترودها و اندازه نمونه بستگی دارد. فضای آزاد بالای نمونه را تا حد ممکن کوچک نگه دارید، اما فضایی برای تیترکننده و غوطه ور شدن کامل بخش شناساگر الکترود در نظر بگیرید. برای الکترود های معمولی، از یک بشر 200 میلی لیتر Berzelius بلند بدون دهانه استفاده کنید. بشر را با یک درب مناسب دارای سه سوراخ برای قرار دادن دو الکترود و بورت بپوشانید. با یک الکترود مرجع شیشه ای ترکیبی کوچک، از یک فلاسک ارلن مایر 125 میلی لیتر یا 250 میلی لیتر با یک درپوش دو سوراخ استفاده کنید.
پ) همزن مغناطیسی
ت) پیپت، حجمی.
ث) فلاسک، حجمی، 1000، 200، 100 میلی لیتر.
ج) بورت، شیشه بوروسیلیکات، 50، 25، 10 میلی لیتر.
چ) بطری پلی اولفین، 1 لیتر.
معرفها
الف) آب عاری از دی اکسید کربن: کلیه محلول های استوک و استاندارد و آب رقیق کننده برای فرایند استاندارد سازی با آب مقطر یا دیونیزه شده که به مدت 15 دقیقه تازه جوشانده شده است و تا دمای اتاق سرد شده است تهیه گردد. pH نهایی آب باید 6.0 ≥ و هدایت آن باید < 2 μmhos/cm باشد.
ب) محلول پتاسیم هیدروژن فتالات ، تقریباً 0.05N: 15 تا 20 گرم استاندارد اولیه KHC8H4O4 را تا اندازه حدود 100 مش آسیاب کنید و در دمای 120 درجه سانتیگراد به مدت 2 ساعت خشک کنید. در دسیکاتور سرد کنید. وزنی معادل 10.0 ± 0.5 g گرم (با نزدیکترین میلی گرم) ، به یک فلاسک حجمی 1 لیتری منتقل کرده و تا 1000 میلی لیتر به حجم برسانید.
پ) تیترانت هیدروکسید سدیم استاندارد، 0.1N: محلول تقریبا 0.1N همانطور که در آماده سازی معرف های میز گفته شده است تهیه کنید. با تیتر کردن 40.00 میلی لیتر محلول KHC8H4O4 (3 ¶) ، با استفاده از یک بورت 25 میلی لیتر استاندارد سازی کنید. تا نقطه انحنا که باید نزدیک به pH 8.7 باشد تیتر کنید. نرمالیته NaOH را محاسبه کنید:
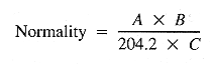
جایی که:
= A مقدار گرم KHC8H4O4 درون فلاسک 1 لیتری ،
= B مقدار میلی لیتر محلول KHC8H4O4 استفاده شده برای تیتراسیون ، و
C = مقدار میلی لیتر محلول NaOH استفاده شده.
در محاسبات بیشتر از نرمالیته ی اندازه گیری شده استفاده کنید یا روی 0.1000N تنظیم کنید. 1 میلی لیتر = 5.00 میلی گرم CaCO3.
ت) تیترانت سدیم هیدروکسید استاندارد ، N 0.02: 200 میلی لیتر NaOH 1 نرمال را تا حجم 1000 میلی لیتر رقیق کنید و در یک بطری پلی الیفین محافظت شده از CO2 اتمسفر توسط یک لوله آهک سودا یا درپوش محکم ذخیره کنید. طبق توضیحات بخش 3C با KHC8H4O4 استاندارد کنید، از 15.00 میلی لیتر محلول KHC8H4O4 و یک بورت 50 میلی لیتری استفاده کنید. نرمالیته را مانند بالا محاسبه کنید ;(3c) 1 میلی لیتر = 1.00 میلی گرم CaCO3.
ث) پراکسید هیدروژن ، H2O2 ، 30٪.
ج) محلول شناساگر بروم فنول آبی، شناساگر: pH=3.7 100 میلی گرم بروم فنول آبی و نمک سدیم را در 100 میلی لیتر آب حل کنید.
چ) محلول شناساگر متاکرزول بنفش، شناساگر pH=8.3 : 100 میلی گرم متاکرزول بنفش را در 100 میلی لیتر آب حل کنید.
ح) محلول شناساگر فنل فتالین ، الکلی ، شناساگر pH=8.3.
خ) تیوسولفات سدیم ، 0.1 مولار: 25 گرم Na2S2O3⋅5H2O را حل کنید و با آب مقطر تا حجم 1000 میلی لیتر رقیق کنید.
فرایند
اگر نمونه عاری از یون های فلزی قابل هیدرولیز شدن باشد و فرم های کاتیونی چند فاز را احیا می کند، با توجه به b ، c یا d آنالیز را انجام دهید. اگر نمونه چنین موادی دارد یا مشکوک به داشتن چنین موادی است، مطابق با a از قبل آماده کنید.
الف) آماده سازی پراکسید داغ: یک نمونه مناسب (1 ¶) را در فلاسک های تیتراسیون بریزید. pH را اندازه گیری کنید. اگر pH بالاتر از 4.0 است ، 5 میلی لیتر از اسید سولفوریک (H2SO4) N 0.02 (بخش 2320B.3c) اضافه کنید تا pH را به 4 یا کمتر کاهش دهید. الکترودها را بردارید. 5 قطره H2O2 30٪ را اضافه کرده و به مدت 2 تا 5 دقیقه بجوشانید.
طبق فرایند 4d، دمای اتاق را سرد کنید و با محلول استاندارد قلیایی تا pH=8.3 تیتر کنید.
ب) تغییر رنگ: اندازه نمونه و نرمالیته تیترانت را مطابق با شرایط e1 انتخاب کنید. در صورت لزوم نمونه را با دمای اتاق تنظیم کنید و در حالی که نوک پیپت را در نزدیکی کف فلاسک نگه داشته اید ، با استفاده از پیپت نمونه را داخل یک فلاسک ارلن مایر تخلیه کنید. در صورت وجود كلر باقيمانده آزاد ، 0.05 ميلي ليتر (1 قطره) محلول Na2S2O3 0.1 مولار را اضافه كنيد، يا با تشعشعات فرابنفش ان ها را از بين ببريد.
0.2 میلی لیتر (5 قطره) محلول شناساگر را اضافه کرده و روی یک سطح سفید تا ظهور تغییر رنگ ثابت و رسیدن به نقطه تعادل تیتراسیون را ادامه دهید. محلول یا ماده جامد شناساگر تجاری برای محدوده pH (3.7 یا 8.3) ممکن است مورد استفاده قرار گیرند. رنگ را در نقطه انتهایی با اضافه کردن همان غلظت شناساگر مورد استفاده با نمونه در محلول بافر در pH تعیین شده بررسی کنید.
ج) منحنی تیتراسیون پتانسیومتری:
1) الکترودها و ظرف تیتراسیون را با آب مقطر بشویید . اندازه نمونه و نرمالیته تیترانت را مطابق با شرایط e1 انتخاب کنید. در صورت لزوم نمونه را با دمای اتاق تنظیم کنید و در حالی که نوک پیپت را در نزدیکی کف ظرف تیترانت نگه داشته اید ، با استفاده از پیپت نمونه تخلیه کنید.
2) pH نمونه را اندازه گیری کنید. محلول استاندارد قلیایی را در مقادیر 0.5 میلی لیتر یا کمتر اضافه کنید ، به طوری که تغییر واحد pH کمتر از 0.2 در هر افزایشی رخ می دهد. بعد از هر بار افزودن ، با همزن مغناطیسی به آرامی آن را مخلوط کنید. از پاشیدن خودداری کنید. pH را هنگامی که ثابت شد، ثبت کنید.
به افزودن تیترانت ادامه دهید و pH را اندازه بگیرید تا به 9 برسد. منحنی تیتراسیون را بر اساس مقادیر pH مشاهده شده و حجم تیترانت اضافه شده رسم کنید. یک منحنی صاف با یک یا چند شکستگی بدست می آید. یک منحنی نامنظم نشان می دهد که تعادل پس از افزودن های قلیایی حاصل نشده است. میزان اسیدیته را نسبت به pH از منحنی مشخص کنید.
د تیتراسیون پتانسیومتری به 3.7 pH یا 8.3: نمونه و تیتراسیون را مطابق با 4C1 آماده کنید. تا نقطه پایانی انتخاب شده pH (1d) بدون ثبت مقادیر میانی pH تیتراسیون را انجام دهید. با نزدیک شدن به نقطه پایانی ، افزودن قلیاییت را کمتر کنید و مطمئن شوید که قبل از اضافه کردن بعدی ، نقطه تعادل pH حاصل شده است.
محاسبات
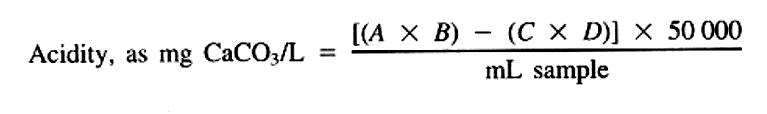
بطوریکه:
A = میلی لیتر تیترانت NaOH استفاده شده،
B = نرمالیته NaOH،
C = میلی لیتر H2SO4 استفاده شده (4a)، و
D = نرمالیته H2SO4.
pH نقطه پایانی را به شرح زیر گزارش کنید:
‘‘The acidity to pH _______ = _______ mg CaCO3/L.’’
اگر مقدار منفی به دست آمد ، مقدار آن را منفی گزارش کنید. مقدار مطلق این مقدار منفی باید معادل قلیایی خالص باشد.
دقت و انحراف
به دلیل تنوع زیاد در خصوصیات نمونه، هیچ گزارشی کلی درباره دقت ان ارائه نشده است. دقت تیتراسیون ا بسیار بیشتر از عدم قطعیتهای مربوط به نمونه قبل از تجزیه و تحلیل است.
چهل تحلیلگر در 17 آزمایشگاه نمونه آب مصنوعی حاوی مقادیر بی کربنات معادل CaCO3/L mg 20را تجزیه و تحلیل کردند. تیتراسیون طبق روش 4d انحراف استاندارد ناچیز CaCO3/L mg 1.8 را نشان داد. پنج آزمایشگاه دو نمونه حاوی اسید سولفوریک ، اسید استیک، فرمیک اسید و کلرید آلومینیوم را با روشهای 4bو 4d تجزیه و تحلیل کردند. میانگین اسیدیته یک نمونه (به pH 3.7) CaCO3/L mg 487 با انحراف استاندارد 11 میلی گرم در لیتر بود.
تیتراسیون برموفنول بلو در همان نمونه با انحراف استاندارد 110 میلی گرم در لیتر،90 میلی گرم در لیتر بیشتر بود . تیتراسیون پتانسیومتری نمونه دیگر با انحراف استاندارد 54 میلی گرم در لیتر ، 547 میلی گرم در لیتر است; در حالی که نتیجه شناساگر مربوطه با یک انحراف استاندارد 56 میلی گرم در لیتر، 85 میلی گرم در لیتر بیشتر بود ،. تفاوت عمده بین نمونه ها جایگزینی سیترات آمونیوم آهن در نمونه دوم برای بخشی از کلرید آلومینیوم بود.
Bibliography
WINTER, J.A. & M.R. MIDGETT. 1969. FWPCA Method Study 1. Mineral and Physical Analyses.
Federal Water Pollution Control Admin., Washington, D.C.
BROWN, E., M.W. SKOUGSTAD & M.J. FISHMAN. 1970. Methods for collection and analysis of water samples for dissolved minerals and gases. Chapter A1 in Book 5, Techniques of Water-Resources Investigations of United States Geological Survey. U.S. Geological Survey, Washington, D.C.
SNOEYINK, V.L. & D. JENKINS. 1980. Water Chemistry. John Wiley & Sons, New York, N.Y.
منبع: Standard Methods for the Examination of Water and Wastewater



