

اصطلاح
در اصل، سختی آب به عنوان معیاری برای اندازه گیری ظرفیت آب برای ترسیب صابون در نظر گرفته می شود. صابون عمدتا توسط یون های کلسیم و منیزیم ترسیب می شود. دیگر کاتیون های چند ظرفیتی(بیشتر از 2 ظرفیت) نیز ممکن است صابون را ترسیب کنند، اما اغلب آنها در فرم های پیچیده و کمپلکس با ترکیبات ارگانیک بوده، و نقش آنها در سختی آب ناچیز و در نتیجه به دشواری قابل اندازه گیری می باشد. با توجه به عملکرد فعلی، سختی کل به عنوان مجموع غلظت کلسیم و منیزیم، هر دو بر حسب میلی گرم کربنات کلسیم، در هر لیتر تعریف شده است. سختی کل
هنگامی که سختی از نظر عددی بیشتر از مقدار قلیائیت کربنات و بی کربنات است، این مقدار سختی معادل قلیائیت کل می باشد، که “سختی کربنات” نام دارد؛ مقدار باقی مانده سختی، “سختی غیر کربنات” یا اضافه سختی نامیده می شود. هنگامی که سختی به صورت عددی برابر یا کمتر از مقدار قلیائیت کربنات و بی کربنات است، تمام سختی سختی کربناتی است و سختی غیر کربناتی وجود ندارد. سختی ممکن است از صفر تا صدها میلیگرم در لیتر، بسته به منبع و نوع تصفیه آب، متغیر باشد. سختی کل
انتخاب روش
دو روش ارائه شده است. روش B، سختی به وسیله محاسبه، برای همه انواع آبها قابل استفاده است و نتایجی با دقت بالاتر را می دهد. اگر آنالیز معدنی انجام شود، سختی محاسباتی را می توان گزارش کرد. روش C، روش تیتراسیون EDTA (Ethylenediaminetetraacetic acid) ، جهت اندازه گیری یونهای کلسیم و منیزیم است و ممکن است با تغییرات مناسب برای هر نوع آب از این روش استفاده شود. روش شرح داده شده راهی برای تجزیه و تحلیل سریع است.
نتایج گزارش
هنگام گزارش سختی، باید روش استفاده شده برای مثال “hardness (calc.)” یا “hardness (EDTA)” مشخص شود.
روش اندازه گيري سختي بوسيله محاسبات:
روش توضيح داده شده براي تعيين سختی محاسبه ی آن از نتايج اندازه گیری مجزا كلسيم و منيزيم می باشد. يعني به طور مثال :

روش تيتراسیون با EDTA :
اتیلن دای آمین تترا استیک اسيد و نمك های سديم آن (به اختصار EDTA) وقتی به یک محلول از کاتیون های فلزی ویژه افزوده شود، يك كمپلكس کیلیت شده ی محلول تشکیل می دهند. اگر يك مقدار كم از يك تركيب رنگي مانند اريوكروم بلاك تی به محلول آبي شامل یون های Ca2+ , Mg2+ در pH =10.0+0.1 افزوده شود، محلول قرمز شرابي مي شود. در اثر اضافه كردن EDTA بعنوان تيترانت، كلسيم و منيزيم به حالت كمپلكس تبديل مي شوند و وقتي همه Mg , Ca بصورت كمپلكس درآمدند رنگ محلول از قرمز شرابی به آبي تبدیل مي شود كه نشان دهنده نقطه پاياني تيتراسيون است.
جهت دست یابی به نقطه پاياني رضایت بخش باید حتما یون منیزیم حضور داشته باشد. براي اطمينان حاصل كردن از اين موضوع , مقداري از نمك خنثي Mg كمپلكس شده با EDTA را به بافر اضافه کنید. اين کار بطور اتوماتيك منيزيم كافي را تامین و نیاز به تصحيح توسط نمونه شاهد را رفع مي كند . تيزي نمودار در نقطه پاياني با افزايش pH افزايش مي يابد. اگرچه pH نمي تواند به صورت نامحدود افزايش يابد چون خطر رسوب كربنات كلسيم يا هيدروكسيد منيزيم وجود دارد و معرف در pH بالا تغيير رنگ مي دهد. pH مشخص 10±0.1 يك مقدار توافقی رضايت بخش است. محدوده زمان 5 دقیقه برای مدت تیتراسیون برای کاهش تمایل به تشکیل رسوب CaCO3 تعیین شده است.
خدمات آزمایشگاهی شرکت پژوهشی صنعتی آبریزان
ب مزاحمت: بعضی از یون های فلزی با محو یا نامشخص کردن نقاط پایانی و یا استفاده ی استوکیومتری EDTA ایجاد مزاحمت می کنند. این تداخل را با افزودن برخی بازدارنده ها قبل از تیتراسیون، کاهش دهید. MgCDTA [2b3]]، به طور انتخابی با فلزات سنگین ایجاد کمپلکس کرده، منیزیم را به نمونه آزاد می کند و می تواند بعنوان جایگزینی برای بازدارنده های سمی یا بد بو استفاده شود. این روش تنها زمانی مفید است که منیزیم جایگزین فلزات سنگین روی مقدار سختی کل تاثیر قابل توجهی نمی گذارد. برای غلظت فلزات سنگین یا پلی فسفات پایین تر از مقادیری که در جدول 2340 نشان داده شده است: I، از بازدارنده I یا II استفاده کنید. هنگامی که غلظت های بالاتر فلزات سنگین وجود دارد، کلسیم و منیزیم را با روش غیر EDTA تعیین کنید (به بخش 3500-Ca و بخش 3500-Mg مراجعه کنید) و سختی را با محاسبه به دست آورید. ارقام جدول 2340:I فقط به عنوان یک راهنمای تخمینی طراحی شده و بر اساس استفاده از یک نمونه 25 میلی لیتر رقیق شده تا 50 میلی لیتر است.
مواد آلی معلق یا کلوئیدی نیز ممکن است در نقطه پایانی تداخل ایجاد کنند. این تداخل را از طریق تبخیر نمونه تا خشک شدن کامل در حمام بخار و حرارت دادن در کوره های موفلی (آستردار) در دمای 550 درجه سانتیگراد تا زمانی که مواد آلی به طور کامل اکسید شوند، از بین ببرید. باقی مانده را در 20 میلی لیتر هیدروکلریک اسید (HCl) 1 نرمال حل نموده و با سدیم هیدروکسید (NaOH) 1نرمال تا pH 7 خنثی کرده و با آب مقطر به 50 میلی لیتر برسانید. دمای اتاق را خنک نگه دارید و طبق روش کلی ادامه دهید.
ج احتياطات تيتراسيون: تيتراسيون را در دماي اتاق يا نزديک آن انجام دهيد. با نزدیک شدن دمای نمونه تا نقطه ی انجماد تغییر رنگ به طور خاصی آرام صورت می پذیرد. تجزیه شناساگر در آب گرم مشکل ایجاد می کند.
pH مشخص شده می تواند محیطی را ایجاد کند که باعث رسوب CaCO3 شود. اگر چه تیترانت به آرامی این رسوبات را دوباره تجزیه می کند، نقطه پایانی drifting اغلب نتیجه های کمتری را به ارمغان می آورد. تکمیل تيتراسيون در عرض 5 دقيقه تمايل به رسوب کلسيم کربنات را کاهش می دهد. سه روش زیر نیز رسوب گذاری را کاهش می دهد:
1) نمونه را برای کاهش غلظت CaCO3 با آب مقطر رقیق کنید. این روش ساده در این فرایند گنجانده شده است. اگر در این رقت 1 + 1 رسوب گذاری اتفاق بیفتد، از روش 2) یا 3) استفاده کنید. استفاده از یک نمونه کوچک، یک خطای سیستماتیک به علت خطای خواندن بورت ایجاد می کند.
2) اگر سختی تقریبی تشخیص داده شود یا با تیتراسیون اولیه تعیین شده باشد، قبل از تنظیم pH با بافر، مقدار 90 درصد یا بیشتر از نمونه را اضافه کنید.
3) نمونه را اسیدی کرده و برای خروج CO2 قبل از تنظیم PH به مدت 2 دقیقه هم بزنید. قلیائیت را تعیین کنید تا مقدار اسیدی که باید اضافه شود، تعیین گردد.
معرفها
الف) محلول بافر:
1) 16.9 گرم آمونیم کلرید (NH4Cl) را در 143 میلی لیتر گاز اکسید آمونیوم(NH4OH) حل کنید. 1.25 گرم نمک منیزیم EDTA را اضافه کنید (به صورت تجاری) و با آب مقطر به حجم 250 میلی لیتر برسانید.
2) اگر نمک منیزیم EDTA در دسترس نباشد، 1.179 گرم نمک دی سدیم اتیلن دی آمین تترا استیک اسید دی هیدرات (گرید آزمایشگاهی) و 780 میلی گرم سولفات منیزیم (MgSO4 · 7H2O) یا 644 میلی گرم کلرید منیزیم (MgCl2 · 6H2O) در 50 میلی لیتر آب مقطر حل کنید. این محلول را به 9/16 گرم NH4Cl و 143 میلی لیتر NH 4OH غلیظ اضافه کنید و با آب مخلوط کرده و به حجم 250 میلی لیتر برسانید. برای دستیابی به بالاترین دقت، مقدار اکی والان دقیق را با افزودن مناسب مقدار کمی EDTA یا MgSO4 یا MgCl2، تنظیم کنید.
محلول 1) یا 2) را برای مدت بیش از 1 ماه در یک ظرف پلاستیکی یا شیشه ای بوروسیلیکات نگهداری کنید. برای جلوگیری از از دست رفتن آمونیاک (NH3) یا جذب دی اکسید کربن (CO2)، بطری را محکم ببندید. محلول بافر را با استفاده از یک پیپت حباب دار بردارید. هنگامي كه 1 يا 2 ميلي ليتر بافر به نمونه اضافه شد، افزودن بافر را متوقف کرنید، تا pH 10.0 ± 0.1 را در نقطه پایانی تيتراسيون رد کنید.
3) “” بافر های بی بو ” جایگزین مناسبی هستند که به صورت تجاری در دسترس هستند. آنها حاوی نمک منیزیم EDTA هستند و مزیت آن ها این هست که نسبتا بی بو و پایدارتر از NH4Cl-NH4OH هستند. معمولا به دلیل واکنش های آهسته، نقطه پایانی به خوبی NH4Cl-NH4OH حاصل نمی کنند و در صورتی که این روش استفاده شود، ممکن است نامناسب باشد. یکی از این بافر ها را با مخلوط کردن 55 میلی لیتر هیدروکلریک اسید غلیظ با 400 میلی لیتر آب مقطر تهیه کنید و سپس به آرامی و با هم زدن، 300 میلی لیتر 2-آمین اتانول (بدون آلومینیوم و فلزات سنگین) اضافه کنید. 5.0 گرم نمک منیزیم EDTA را اضافه کنید و با آب مقطر تا حجم یک لیتر رقیق کنید. سختی کل
ب) عوامل کمپلکس دهنده: برای اکثر آب ها هیچ عامل کمپلکس دهنده ای لازم نیست. گاهی اوقات آب حاوی یون های مزاحم نیاز به افزودن عوامل کمپلکس دهنده مناسب برای تغییر رنگ واضح و شدید در نقطه پایانی دارد. موارد زیر مناسب هستند:
1) شناساگر I : نمونه های اسیدی را توسط بافر یا 0.1 NaOH نرمال در pH 6 یا بالاتر با تنظیم کنید. 250 میلی گرم سدیم سیانید (NaCN) را به صورت پودر اضافه کنید. بافر کافی برای تنظیم pH 10.0 ± 0.1 اضافه کنید.
(احتیاط: NaCN بسیار سمی است و در استفاده از آن اقدامات احتیاطی بیشتری را انجام دهید. محلول های حاوی این بازدارنده پس از حصول اطمینان از عدم وجود اسید جهت تجزیه هیدروژن سیانید سمی فرار، با استفاده از مقدار زیادی از آب، تخلیه شوند.
2) شناساگر II: 5.0 گرم سولفید سدیم غیر هیدراته (Na2S⋅9H2O) یا 3.7 گرم Na2S⋅5H2O را در 100 میلی لیتر آب مقطر حل کنید. با یک مانع لاستیکی مانع ورود هوا به ظرف شوید. این بازدارنده از طریق اکسیداسیون توسط هوا از بین می رود. یک رسوب سولفیدی تولید می کند که نقطه پایانی را زمانی که غلظت قابل توجه فلزات سنگین وجود دارد پنهان می کند. از 1 میلی لیتر در ¶ 3b استفاده کنید.
3) MgCDTA: نمک منیزیم 1، 2-cyclohexanediaminetetraacetic اسید. 250 میلی گرم شناساگر به ازای هر 100 میلی لیتر نمونه اضافه کردن و قبل از اضافه کردن محلول بافر به طور کامل حل کنید. از این عوامل کمپلکس دهنده برای جلوگیری از استفاده از بازدارنده های سمی یا بد بو در هنگام حضور عوامل مزاحم در غلظت هایی که بر روی نقطه پایان تاثیر می گذارند، اما به میزان قابل توجهی روی مقدار سختی تاثیر نمی گذارند، استفاده کنید. محصول تجاری ترکیب بافر و یک عامل کمپلکس دهنده در دسترس است. در چنین ترکیباتی باید در طول تیتراسیون PH 10.0 ± 0.1 حفظ شوند و زمانی که نمونه تیتر می شود نقطه پایانی واضح و دقیقی حاصل شود. سختی کل
ج شناساگرها: بسیاری از انواع محلول های شناساگر، اگر تحلیلگر نشان دهد که آنها مقادیر دقیق را ارائه می دهند، معرفی و توصیه می شوند و ممکن است مورد استفاده قرار گیرند. مشکل اصلی با محلول های شناساگر کاهش کارایی آن ها با گذر زمان است، که نقطه پایانی نا مشخصی را حاصل می کند. به عنوان مثال، محلول های قلیایی Eriochrome Black T به اکسیدان ها حساس هستند و محلول های آبی یا الکلی آن ناپایدار هستند. به طور کلی، از حداقل مقدار شناساگر استفاده کنید تا نقطه پایانی تیزی حاصل شود. این مسئولیت تحلیلگر است که به طور جداگانه میزان غلظت بهینه ی شناساگر را تعیین کند.
1) Eriochrome Black T: نمک سدیم 1-(1-hydroxy-2-naphthylazo)-5-nitro-2-naphthol-4-sulfonic acid : شماره 203 در فهرست رنگ. 0.5 گرم رنگ را در 100 گرم 2,2′,2ʺ-nitrilotriethanol (همچنین به نام تری اتانول آمین) یا 2-metoxymethanol (همچنین به نام اتیلن گلیکول مونو متیل اتر) حل کنید. 2 قطره به ازای هر 50 میلی لیتر محلول اضافه کنید. در صورت لزوم حجم صدا را تنظیم کنید.
2) Calmagite: 1- (1-hydroxy-4-methyl-2-phenylazo) -2-naphthol-4-sulfonic acid. این در محلول آبی پایدار است و تغییر رنگ همانند Eriochrome Black T را با نقطه پایانی واضح تر ایجاد می کند. 0.10 گرم کالمگیت را در 100 میلی لیتر آب مقطر حل کنید. از 1 میلی لیتر در هر محلول 50 میلی لیتر برای تثبیت استفاده کنید. در صورت لزوم حجم را تنظیم کنید. سختی کل
3) در صورتی که مراقب باشید که از شناساگر اضافی استفاده نشود، شناساگرهای 1 و 2 را می توان در فرم پودر خشک استفاده کرد. مخلوط های خشک شده از این شناساگرها و نمک بی اثر به صورت تجاری در دسترس هستند. اگر تغییر رنگ این شناساگرها در نقطه پایانی واضح و تیز نباشد، معمولا این بدان معنی است که یک عامل کمپلکس دهنده مناسب لازم است. اگر بازدارنده NaCN نقطه پایانی را تیز نمی کند، احتمالا این شناساگر اشتباه است.
د تیترانت EDTA استاندارد ، 0.01M: 3.723 گرم disodium ethylenediaminetetraacetate dihydrate، همچنین (ethylenedinitrilo)tetraacetic acid disodium salt (EDTA) نامیده می شود، را در آب مقطر حل و به حجم 1000 میلی لیتر برسانید. با محلول استاندارد کلسیم (¶ 2e) طبق بند ¶ 3b که در زیر توضیح داده شده است، استاندارد کنید. از آنجا که تیترانت کاتیون های ایجاد کننده سختی را از ظروف شیشه ای استخراج می کند، در ظروف پلی اتیلن (ترجیحا) و یا بطری شیشه ای بورسیلیکات نگهداری کنید. تضعیف تدریجی در اثر استاندارد سازی دوره ای را با استفاده از یک عامل تصحیح کننده مناسب، جبران کنید.
ه) محلول استاندارد کلسیم: 1.000 گرم پودر CaCO3 بدون آب (استاندارد اولیه یا مواد خاص با فلزات سنگین، قلیایی و منیزیم کم) را به یک فلاسک ارلن مایر 500 میلی لیتر بیفزایید. یک قیف را در دهانه فلاسک بگذارید و در هر بار مقدار کمی HCl 1 به 1 اضافه کنید تا کل CaCO3 حل شود. 200 لیتر آب مقطر اضافه کنید و برای خارج کردن CO2 چند دقیقه بجوشانید. سرد کنید، چند قطره شناساگر متیل رد را اضافه کنید و با اضافه کردن NH4OH 3 نرمال یا HCl 1 به 1 رنگ را به حالت نارنجی متوسط مورد نظر تنظیم کنید. محلول را به صورت کمی منتقل کرده و با آب مقطر تا حجم 1000 میلی لیتر رقیق کنید؛ 1 میلی لیتر = 1.00 میلی گرم CaCO3.
و) هیدروکسید سدیم، NaOH، 0.1N.
روش
الف پیش آماده سازی نمونه های آب آلوده و فاضلاب: استفاده از هضم نیتریک اسید – سولفوریک اسید یا نیتریک اسید – پرکلریک اسید (بخش 3030).
ب تیتراسیون نمونه: یک حجم نمونه را انتخاب کنید که کمتر از 15 میلی لیتر تیترانت EDTA لازم داشته باشد و تیتراسیون را در عرض 5 دقیقه از زمان اضافه کردن بافر کامل کنید.
25.0 میلی لیتر نمونه را تا حجم حدود 50 میلی لیتر توسط آب مقطر در یک ظرف مناسب دیگر رقیق کنید. 1 تا 2 میلی لیتر محلول بافر اضافه کنید. معمولا 1 میلی لیتر برای به دست آوردن pH 10 تا pH 10.1 کافی است. عدم وجود تغییر رنگ شدید در نقطه ی پایانی تیتراسیون معمولا به این معنی است که در این نقطه باید بازدارنده اضافه شود (¶ 2b et seq.) یا شناساگر خراب شده است. سختی کل
1 تا 2 قطره محلول شناساگر یا مقدار مناسب پودر خشک شناساگر اضافه کنید [¶ 2c3]]. تیترانت استاندارد EDTA را به آرامی، با هم زدن مداوم، اضافه کنید تا آخرین نشانه های رنگ قرمز مایل به زرد ناپدید شود. چند قطره آخر را در فاصله 3 تا 5 ثانیه اضافه کنید. در نقطه ی پایانی محلول به طور معمول آبی است. نور روز یا لامپ فلورسنت با نور روز به شدت توصیه می شود چرا که لامپ های معمولی رشته ای در رنگ آبی مربوط به نقطه پایانی مقداری رنگ قرمز ایجاد می کنند.
اگر نمونه کافی در دسترس باشد و تداخل وجود نداشته باشد، با افزایش اندازه نمونه، دقت کار را بهبود ببخشید، همانطور که در ¶ 3c در زیر توضیح داده شده است.
ج نمونه با سختی کم: برای خروجی دستگاه تبادل یون یا دیگر آب های نرم شده و برای آب هایی با مقدار سختی طبیعی (کمتر از 5 میلی گرم بر لیتر) برای تیتراسیون نمونه ای بزرگتر از 100 تا 1000 میلی لیتر انتخاب کنید و مقدار نسبتا بیشتر از بافر، بازدارنده و شناساگر اضافه کنید. تیترانت استاندارد EDTA را توسط یک میکرو بورت به آرامی اضافه کنید و یک نمونه شاهد با استفاده از آب دوبار تقطیر، آب مقطر یا آب دیونیزه شده هم حجم با نمونه، که حاوی مقادیر یکسان از بافر، بازدارنده و شناساگر می باشد، تهیه کنید. حجم EDTA استفاده شده برای نمونه شاهد را از حجم EDTA مورد استفاده برای نمونه کم کنید.
محاسبات:
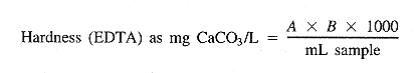
که: سختی کل
A = میلی لیتر تیتراسیون برای نمونه
B = میلی گرم کلسیم کربنات معادل با 1.00 میلی لیتر تیترانت EDTA
دقت و تقصیر
یک نمونه سنتزی حاوی 610 میلی گرم بر لیتر سختی کل به صورت CaCO3 با 108 میلی گرم کلسیم در لیتر و 82 میلی گرم منیزیم در لیتر، و مواد افزودنی زیر: 3.1 میلی گرم پتاسیم در لیتر، 19.9 میلی گرم سدیم در لیتر، 241 میلی گرم یون کلر در لیتر ، 0.25 میلی گرم NO2 -N / L، 1.1 میلی گرم NO3 -N / L، 259 میلی گرم SO4 2- / L و 5/42 میلی گرم کل قلیائیت / L (توسط NaHCO3) در آب مقطر در 56 آزمایشگاه توسط روش تیتراسیون EDTA با انحراف استاندارد نسبي 2.9٪ و خطاي نسبي 0.8٪ آنالیز شد.
6. Bibliography
CONNORS, J.J. 1950. Advances in chemical and colorimetric methods. J. Amer. Water Works Assoc. 42:33.
DIEHL, H., C.A. GOETZ & C.C. HACH. 1950. The versenate titration for total hardness. J. Amer. Water Works Assoc. 42:40.
BETZ, J.D. & C.A. NOLL. 1950. Total hardness determination by direct colorimetric titration. J. Amer. Water Works Assoc. 42:49.
GOETZ, C.A., T.C. LOOMIS & H. DIEHL. 1950. Total hardness in water: The stability of standard disodium dihydrogen ethylenediaminetetraacetate solutions. Anal. Chem. 22:798.
DISKANT, E.M. 1952. Stable indicator solutions for complexometric determination of total hardness in water. Anal. Chem. 24:1856.
BARNARD, A.J., JR., W.C. BROAD & H. FLASCHKA. 1956 & 1957. The EDTA titration. Chemist Analyst 45:86 & 46:46.
GOETZ, C.A. & R.C. SMITH. 1959. Evaluation of various methods and reagents for total hardness and calcium hardness in water. Iowa State J. Sci. 34:81 (Aug. 15).
SCHWARZENBACH, G. & H. FLASCHKA. 1969. Complexometric Titrations, 2nd ed. Barnes & Noble, Inc., New York, N.Y.
Reference: Standard Methods for the Examination of Water and Wastewater
ترجمه شده توسط مریم سلطانی



