
مقدمه:
کربنات نمکی از اسید کربنیک (H2CO3) است که با حضور یون کربنات، یک یون چند اتمی که با فرمول –CO32 مشخص می شود. و بی کربنات یک شکل میانی در پروتون زدایی اسید کربنیک است. این یک آنیون چند اتمی با فرمول شیمیایی –HCO3 است.
کربنات (–CO32) و بی کربنات (–HCO3) قلیایی بودن آب را اندازه گیری می کند. که مقدار آن توسط تیتراسیون با اسید بدست می آید.
غلظت یون های موجود در آب که یون هیدروژن را خنثی می کند به عنوان قلیاییت شناخته می شود. شناخته شده ترین اجزای قلیا به ترتیب بی کربنات، کربنات و هیدروکسید هستند. این ترکیبات از تجزیه مواد معدنی در خاک یا جو به دست می آیند. علاوه بر منشا معدنی اجزای مذکور، این مواد را می توان از انحلال دی اکسید کربن و از تجزیه میکروبی مواد آلی به دست آورد.
اثرات قلیاییت
خاصیت قلیایی بالا طعم تلخی به آب می دهد. در عین حال، نگرانی عمده در مورد قلیایی بودن آب مربوط به واکنش هایی است که ممکن است بین اجزای قلیا و کاتیون های در آب رخ دهد. رسوب حاصل می تواند منجر به گرفتگی لوله ها و سایر لوازم جانبی شبکه آبرسانی شود. اندازه گیری قلیائیت معمولا در آنالیز آب های طبیعی به عنوان یک متغیر کنترل فرآیند در تصفیه آب و فاضلاب استفاده می شود.
تعریف کمی قلیائیت :
A = [HCO3–] + 2 [CO3-2] + [OH–] _ [H+]
مهمترین ترکیبات موجود در آب که قلیائیت را تعیین می کنند شامل یونهای کربنات (–CO32) و بی کربنات (–HCO3) می باشد. یون های کربنات قادر به واکنش با 2 یون هیدروژن (+H) و خنثی کردن آن هستند و یون های بی کربنات قادر به خنثی کردن یون های +H یا هیدروکسید (–OH) موجود در آب هستند. قلیاییت معمولا بر حسب میلی گرم در لیتر (mg/L) گزارش می شود.
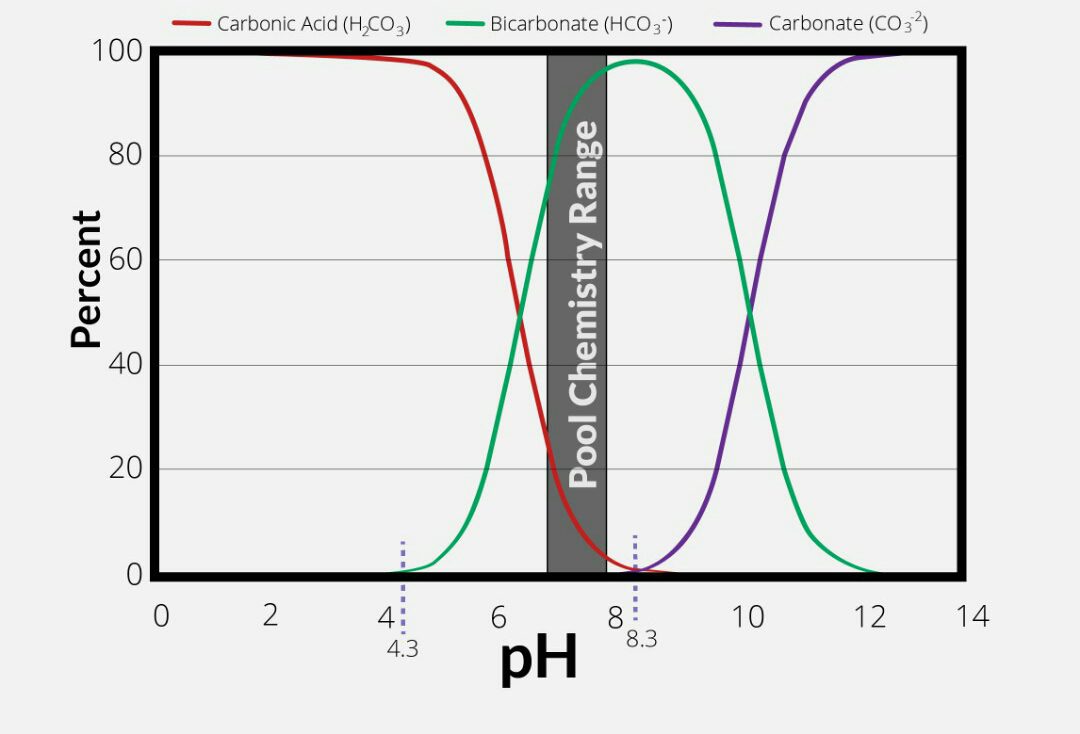
منطقه ای که در آن تعادل بین بی کربنات و کربنات به سمت بی کربنات است، pH اکثر آب های طبیعی بین 6 تا 8/5 است. در بیشتر موارد غلظت بی کربنات به مراتب بیشتر از غلظت هیدروکسید یا یون هیدروژن است. بنابراین برای اکثر موقعیت ها قلیاییت تقریبا برابر با غلظت بی کربنات است.
محاسبه قلیائیت بی کربنات، کربنات و هیدروکسید:
- قلیاییت کل مقدار اسید مورد نیاز برای کاهش pH محلول به 4/5 است.
- در صورت مشخص بودن نقاط، به صورت زیر است:
الف. قلیاییت فنل فتالئین (هیدروکسید و ½ کربنات خنثی شده) زمانی رخ می دهد که اسید کافی برای کاهش pH تا 8/3 اضافه شود.(کربنات در واقع به بی کربنات تبدیل می شود)
ب. اسید اضافی برای کاهش pH 8/3 به 4/5، ½ کربنات باقی مانده را خنثی می کند (که قبلا به بی کربنات تبدیل شده است) و محلول بی کربنات نارنجی می شود.
(الف) زمانی که قلیاییت فنل فتالئین صفر نباشد، اما کمتر از قلیائیت کل باشد، قلیایی کربنات وجود دارد.
(ب) در صورتی که قلیاییت فنل فتالئین بیش از نصف قلیائیت کل باشد، قلیائیت هیدروکسید وجود دارد.
ج) در صورتی که قلیاییت فنل فتالئین کمتر از نصف قلیائیت کل باشد، قلیاییت بی کربنات وجود دارد.
د) قلیائیت های بی کربنات و هیدروکسید نمی توانند با هم وجود داشته باشند.
(ه) تمام قلیائیت هیدروکسید تا pH ، 10 خنثی می شود.
ف. تمام کربنات ها تا pH ، 8/3 به بی کربنات تبدیل می شوند.
* آزمایشگاه های شرکت پژوهشی صنعتی آبریزان واقع در پارک علم و فناوری فارس با کادری مجرب و استفاده از دستگاه ها و تجهیزات پیشرفته قادر به اندازه گیری انواع پارامترهای آب از جمله کربنات (–CO32) و بیکربنات (–HCO3) می باشد.
# اندازه گیری کربنات (–CO32) و بیکربنات (–HCO3)
# اندازه گیری کربنات (–CO32) و بیکربنات (–HCO3)
# اندازه گیری کربنات (–CO32) و بیکربنات (–HCO3)
# اندازه گیری کربنات (–CO32) و بیکربنات (–HCO3)
# اندازه گیری کربنات (–CO32) و بیکربنات (–HCO3)