

3500-Ca A. مقدمه
پیدایش و اهمیت
کلسیم (Ca) عنصر سوم در گروه IIA جدول تناوبی است. عدد اتمی آن 20، وزن اتمی 40.08 و ظرفیت 2 است. فراوانی کل Ca در پوسته زمین 4.9 درصد است. در خاک، 0.07 تا 1.7٪ است؛ در آب های جاری حدود 15 میلی گرم در لیتر است؛ و در آبهای زیرزمینی از 1 تا 500 میلی گرم بر لیتر است. شایع ترین انواع کلسیم عبارتند از کربنات کلسیم (کلسیت) و کربنات کلسیم-منیزیم (دولومیت). ترکیبات کلسیم به طور گسترده ای در تولید دارو، عکاسی، آهک، نمک های ضد انجماد، رنگدانه ها، کود و گچ استفاده می شود. حلالیت کربنات کلسیم با pH و CO2 محلول کنترل می شود. تعادل CO2، HCO3 و CO32 مهمترین واکنش در آب های شیرین است. سختی بر اساس غلظت نمک های کلسیم و منیزیم است و اغلب به عنوان معیاری از کیفیت آب آشامیدنی استفاده می شود.

توجه: کلسیم در تغذیه گیاهان و حیوانات ضروری است و جزء اصلی استخوان ها، پوسته ها و ساختار گیاهان است. حضور کلسیم در منابع آب ناشی از گذر آن از رسوبات سنگ آهک، دولومیت، گچ و پوسته ی زمین است. غلظت های اندک کلسیم کربنات با قرار دادن یک پوشش محافظ بر سطح لوله های فلزی از خوردگی آن ها جلوگیری می کند. از آنجا که رسوب کلسیت در لوله ها و در مبدل های حرارتی می تواند باعث آسیب شود، مقدار کلسیم در آب های خانگی و صنعتی اغلب با نرم کردن آب (مانند مبادله یونی، اسمز معکوس) کنترل می شود.
کلسیم به کل سختی آب کمک می کند. برای کاهش کلسیم و سختی مرتبط با آن، استفاده از نرم کننده های شیمیایی، اسمز معکوس، الکترودیالیز یا تبادل یونی مورد استفاده قرار می گیرد.
انتخاب روش
روش جذب اتمی و روش پلاسمای جفت شده ی القایی، روش های دقیق تعیین کلسیم هستند. روش تیتراسیون EDTA <3500-Ca.B) نتایج خوبی برای برنامه های کنترل معمول در اختیار ما قرار می دهد، اما برای نمونه هایی با سطوح بالای P (> 50 میلی گرم در لیتر) تنها روش های جذب اتمی یا انتشار اتمی به دلیل اختلالاتی که در روش EDTA اغلب با آنها مواجه می شوند، توصیه می شود.
ذخیره نمونه ها
جهت انجام اقدامات احتیاطی معمول، کافی است اگر مراقب باشید که مقدار کلسیم کربناتی که در هنگام سکون محلول رسوب کره، دوباره حل شود.
3500-Ca B. روش تیتراسیون EDTA
بحث عمومی
a اصل: هنگامی که EDTA (اتیلن دی آمین تتراستیک اسید یا نمکهای آن) به آبی که حاوی کلسیم و منیزیم است اضافه شود، ابتدا با کلسیم ترکیب می شود. مقدار کلسیم را می توان به طور مستقیم با EDTA تعیین کرد، هنگامی که pH به اندازه کافی بالا می رود، منیزیم به طور عمده به صورت هیدروکسید رسوب می کند و از شناساگری استفاده می شود که تنها با کلسیم ترکیب می شود. زمانی که کل کلسیم با EDTA در pH 12 تا 13 ترکیب شده و تشکیل کمپلکس می دهد، چندین شناساگر هستند که در این شرایط تغییر رنگ از خود نشان می دهند.
b تداخل: تحت شرایط این آزمایش، غلظت یون ها تا مقدار ذکر شده در زیر، در تعیین سختی کلسیم ایجاد مزاحمت و تداخل نمی کند: Cu2 +، 2 mg / L؛ Fe2 +، 20 mg / L؛ Fe3 +، 20 میلی گرم / لیتر؛ Mn2 +، 10 میلی گرم در لیتر؛ Zn2 +، 5 mg / L؛ Pb2 +، 5 mg / L؛ Al3 +، 5 mg / L؛ و Sn4 +، 5 میلی گرم بر لیتر.
ارتوفسفات، کلسیم را در pH آزمایش، رسوب می دهد. استرونسیوم و باریم در مقدار بیش از 300 میلی گرم در لیتر باعث ایجاد تداخل مثبت و خطای قلیایی می شود، که در نتیجه ممکن است نقطه پایانی تیتراسیون در آب های سخت نامعلوم باشد.
معرفها
a هیدروکسید سدیم، NaOH، 1N.
b معرف ها: برای تیتراسیون کلسیم، معرف های زیادی وجود دارد. برخی از آن ها به صورت تجاری آماده و نیز ممکن است مورد استفاده قرار گیرند. مورکساید (آمونیاک خالص) اولین شناساگر برای شناسایی نقطه پایانی در تعیین کلسیم بود؛ دستورالعمل استفاده آن در این روش ارائه شده است. افرادي كه در تشخيص نقطه پاياني مورئيدس با مشکل مواجه هستند، ميتوانند به دليل تغيير رنگ واضح از قرمز به آبی خالص، از شناساگر Eriochrome Blue Black R (شماره رنگ شماره 202) يا Solochrome Dark Blue استفاده کنند. Eriochrome Blue Black R یک سدیم 1- (2-هیدروکسی-1-naphthylazo) -2-naphthol-4-sulfonic acid است. سایر معرف ها به طور خاص برای استفاده به عنوان شناساگرهای نقطه پایانی در تیتراسیون کلسیم توسط EDTA ممکن است مورد استفاده قرار گیرند.
1) شناساگر Murexide (آمونیاک خالص): رنگ این معرف از صورتی تا بنفش در نقطه پایانی تغییر می کند. با حل کردن 150 میلی گرم رنگ در 100 گرم اتیلن گلیکول مطلق، تهیه می شود. محلول های آبی رنگ ها برای مدت بیش از 1 روز پایدار نیستند.
یک مخلوط پایه از پودر رنگی و کلرید سدیم (NaCl) یک فرم پایدار از معرف را فراهم می کند. با مخلوط کردن 200 میلی گرم مورکساید با 100 گرم NaCl جامد و آسیاب کردن مخلوط به 40 تا 50 مش تهیه می شود. بلافاصله پس از اضافه کردن معرف، تیتراسیون را انجام دهید، زیرا در شرایط قلیایی ناپایدار است. تشخیص نقطه پایانی را با تهیه یک رنگ شاهد حاوی 2،0 میلی لیتر محلول NaOH، 0.2 گرم مخلوط شناساگر جامد (یا 1 تا 2 قطره اگر از محلول استفاده می شود) و EDTA استاندارد (0.05 تا 10.10 میلی لیتر) برای تولید یک تغییر ناپذیر، تسریع کنید.
2) Eriochrome Blue Black R indicator: یک فرم پایدار از معرف را با آسیاب کردن 200 میلی گرم رنگ پودری و 100 گرم NaCl جامد تا 40 تا 50 مش، تهیه کنید. در بطری محکم بسته بندی کنید. از 0.2 گرم مخلوط پایه براي تيتراسيون به همان روش مشابه معرف مورئيد استفاده كنيد. در طول تیتراسیون، رنگ از قرمز ابتدا به بنفش تا بنفش مایل به آبی و در نهایت به آبی خالص تغییر می کند و هیچ اثری از رنگ قرمز یا بنفش ندارد. pH برخی از (نه همه) آب ها باید با استفاده از NaOH 8نرمال برای تغییر رنگ خوب به 14 (به جای 12 تا 13) افزایش یابد.
تیترانت استاندارد EDTA، 0.01M: تیترانت استاندارد EDTAرا تهیه و با استفاده از محلول استاندارد کلسیم استاندارد شود، همانطور که در بخش 2340Cتوضیح داده شده (برای به دست آوردن اکی والان (EDTA / CaCO3. تیترانت استاندارد EDTA، 0.0100M، هم اکی والان با 1000 میلی گرم CaCO3 / 1.00mLاست؛ در محاسبات بخش 4 از اکی والان تیترشده به جای Bاستفاده کنید.
3. روش
a آماده سازی نمونه های آب و فاضلاب: در صورتی که نمونه ها نیاز به هضم اولیه داشته باشند، به روش موجود در بخش 3030E یا I مراجعه کنید.
آماده سازی نمونه: به دلیل pH بالا که در این روش استفاده می شود، بلافاصله پس از اضافه کردن باز و معرف، تیتراسیون را انجام دهید. از 50.0 میلی لیتر نمونه یا مقدار کوچکتر رقیق شده تا 50 میلی لیتر استفاده کنید تا مقدار کلسیم حدود 5 تا 10 میلی گرم باشد. آبهای سخت با قلیاییت بالاتر از 300 میلی گرم CaCO3 / L را با استفاده از یک قسمت کوچکتر و رقیق شده تا 50 میلی لیتر تجزیه کنید. روش دیگر، تنظیم pH نمونه در محدوده اسیدی (pH <6)، برای تخلیه CO2 برای 1 دقیقه جوشانده شده و قبل از شروع تیتراسیون، سرد شود.
تریتراسیون: 2.0 میلی لیتر یا یک حجم کافی از محلول NaOH برای ایجاد pH 12 تا 13 اضافه کنید. مخلوط کنید. 0.1 تا 0.2 گرم مخلوط شناساگر را اضافه کنید (یا 1 تا 2 قطره در صورت استفاده از محلول استفاده شود). تیترانت EDTA را به آرامی اضافه کنید، تا رسیدن به نقطه پایانی مداوم به هم بزنید. هنگام استفاده از murexide، نقطه پایان را با اضافه کردن 1 تا 2 قطره تیترانت بیش از حد برای اطمینان از این که هیچ تغییر رنگ دیگری رخ نمی دهد بازنگری کنید.
4. محاسبات
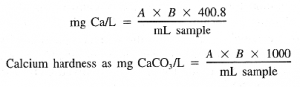
جایی که:
A = میلی گرم تیترانت برای نمونه و
B = میلی گرم کلسیم کربنات معادل 1.00 میلی لیتر تیترانت EDTA در نقطه پایانی معرف کلسیم.
5. دقت و صحت
یک نمونه سنتزی حاوی 108 mg Ca/L, 82 mg Mg/L, 3.1 mg K/L, 19.9 mg Na/L, 241 mg Cl–/L, 1.1 mg NO3 –-N/L, 0.25 mg NO2 –-N/L, 259 mg SO4 2–/L, and 42.5 mg total alkalinity/L (توسط NaHCO3) در آب مقطر در 44 آزمایشگاه با استفاده از روش EDTA، با انحراف استاندارد 9.2٪ و خطای نسبی 1.9٪ مورد آنالیز قرار گرفت.
6. Bibliography
DIEHL, H. & J.L. ELLINGBOE. 1956. Indicator for titration of calcium in the presence of magnesium using disodium dihydrogen ethylenediamine tetraacetate. Anal. Chem. 28:882.
HILDEBRAND, G.P. & C.N. REILLEY. 1957. New indicator for complexometric titration of calcium in the presence of magnesium. Anal. Chem. 29:258.
PATTON, J. & W. REEDER. 1956. New indicator for titration of calcium with (ethylenedinitrilo) tetraacetate. Anal. Chem. 28:1026.
SCHWARZENBACH, G. 1957. Complexometric Titrations. Interscience Publishers, New York, N.Y.
FURMAN, N.H. 1962. Standard Methods of Chemical Analysis, 6th ed. D. Van Nostrand Co., Inc., Princeton, N.J.
KATZ, H. & R. NAVONE. 1964. Method for simultaneous determination of calcium and magnesium. J. Amer. Water Works Assoc. 56:121.



