اندازه گیری کربنات و بی کربنات در آب: راهنمای کامل کنترل قلیاییت

مقدمه: چرا قلیاییت آب برای صنعت مهم است؟
آیا تا به حال فکر کرده اید چرا برخی سیستم های آب گرم کن یا بویلرهای صنعتی پس از مدتی کارایی خود را از دست می دهند؟ یا چرا لوله ها گرفته می شوند و هزینه های نگهداری به طور ناگهانی افزایش پیدا می کند؟ پاسخ بسیاری از این سؤالات در قلیاییت آب نهفته است به ویژه در غلظت یون های کربنات (²₃CO ⁻) و بی کربنات (₃HCO ⁻).
این یون ها نه تنها طعم آب را تحت تأثیر قرار می دهند، بلکه نقش کلیدی در تشکیل رسوبات معدنی، خوردگی تجهیزات و کاهش بازده سیستم های حرارتی دارند. در این مقاله، به صورت ساده و کاربردی با مفاهیم پایه، روش های اندازه گیری، اهمیت صنعتی و راهکارهای مدیریت قلیاییت آشنا خواهید شد.
کربنات و بی کربنات چیستند؟
تعریف شیمیایی
- بی کربنات ( ₃HCO ⁻) :یک آنیون چنداتمی که در واقع شکل میانی از اسید کربنیک (₃CO₂H) است. این یون در pH های معمول آب های طبیعی (بین 6 تا 8.5) غالب است.
- کربنات (₃²CO ⁻) :شکل کاملاً پروتون زدایی شده اسید کربنیک که در محیط های قلیایی تر ( pH بالاتر از 10) پایدار است.
هر دو این یون ها از تجزیه مواد معدنی (مانند سنگ آهک) در خاک یا جذب دی اکسید کربن (₂CO) از جو به آب تشکیل می شوند.
قلیاییت چیست و چرا اندازه گیری آن ضروری است؟
تعریف قلیاییت
قلیاییت (Alkalinity) ظرفیت آب برای خنثیکردن اسیدهاست. به عبارت دیگر، میزان مقاومت آب در برابر کاهش pH. این خاصیت عمدتاً توسط سه یون تعیین می شود:
1. بی کربنات (₃HCO ⁻) — شایع ترین در آب های طبیعی
2. کربنات (₃²CO ⁻)
3. هیدروکسید (OH ⁻)
✍️ فرمول کلی قلیاییت به صورت زیر است:
A =[HCO₃⁻] + 2 [CO⁻²₃] + [OH⁻] - [H⁺]
نکته : هر یون کربنات دو بار بار منفی دارد، بنابراین تأثیر آن دو برابر بی کربنات در قلیاییت است.
چرا قلیاییت مهم است؟
- در سیستم های صنعتی: قلیاییت بالا منجر به تشکیل رسوب کربنات کلسیم (₃CaCO) می شود که بازده مبدل های حرارتی، بویلرها و چیلرها را کاهش می دهد.
- در تصفیه آب: قلیاییت به عنوان یک بافر عمل می کند و از نوسانات ناگهانی pH جلوگیری می کند.
- در شبکه های آبرسانی: رسوبات ناشی از قلیاییت بالا باعث گرفتگی لوله ها و افزایش هزینه های نگهداری می شوند.
روش های اندازه گیری کربنات و بی کربنات
تیتراسیون اسید-باز: روش استاندارد
روش رایج برای اندازه گیری قلیاییت، تیتراسیون با اسید استاندارد (معمولا HCL یا ₄H₂SO) است. در این روش، دو نقطه پایانی مهم وجود دارد:
1. نقطه پایانی فنل فتالئین (pH ≈ 8.3)
- در این مرحله، تمام هیدروکسید و نیمی از کربنات خنثی می شوند.
- رنگ محلول از صورتی به بی رنگ تغییر می کند.
2. نقطه پایانی متیل اورانژ (pH ≈ 4.5)
- در این مرحله، بی کربنات و نیم دیگر کربنات به اسید کربنیک تبدیل می شوند.
- رنگ از زرد به نارنجی تغییر می کند.
تفسیر نتایج تیتراسیون
با مقایسه حجم اسید مصرفی در دو مرحله، می توان نوع یون های غالب را تشخیص داد:
شرایط | نوع قلیاییت |
P = 0 | فقط بی کربنات |
P < T/2 | بی کربنات + کربنات |
P = T/2 | فقط کربنات |
P > T/2 | کربنات + هیدروکسید |
P = T | فقط هیدروکسید |
که در آن:
P= قلیاییت فنل فتالئین
T= قلیاییت کل
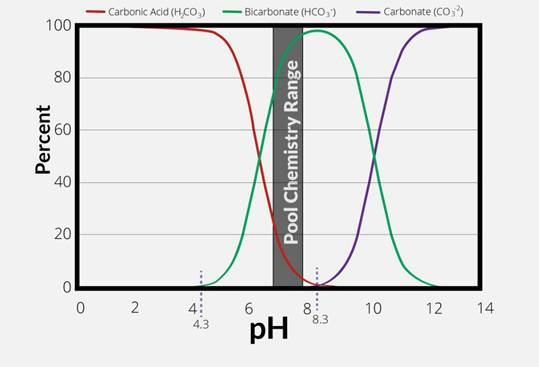
تأثیر pH بر تعادل کربناتی
در آب، سیستم کربنیک
(H₂CO₃/ HCO₃⁻/ CO₃² ⁻)
به شدت به pH وابسته است:
- pH < 4.5 : غالب = ₃H₂CO (اسید کربنیک)
- 4.5 <pH < 8.3 : غالب =₃HCO ⁻(بی کربنات)
- pH > 10.3 : غالب =₃² CO ⁻(کربنات)
بنابراین، در اکثر آب های طبیعی (pH 6–8.5)، بی کربنات بیش از 90% قلیاییت را تشکیل می دهد.
⚡⚡⚡ مشکلات ناشی از قلیاییت بالا در صنعت ⚡⚡⚡
1. تشکیل رسوب (Scaling)
- یون هایCa² ⁺ و Mg² ⁺ با ₃²CO ⁻ واکنش داده و کربنات کلسیم (₃CaCO) تشکیل میدهند.
- این رسوب سفید و سخت، لایهای عایق روی سطوح حرارتی ایجاد می کند.
- نتیجه :کاهش انتقال حرارت، افزایش مصرف سوخت، داغ شدن بیش از حد و خرابی تجهیزات
2. کاهش بازده سیستم های حرارتی
- در بویلرها، رسوب 1 میلی متری می تواند بازده را تا 10% کاهش دهد.
- در چیلرها و مبدل های حرارتی، جریان آب محدود شده و فشار افت می کند.
3. افزایش هزینه های نگهداری
- نیاز به شستشوی شیمیایی مکرر
- تعویض قطعات فرسوده
- توقف خط تولید برای تعمیرات
⭐⭐⭐ راهکارهای مدیریت قلیاییت و پیشگیری از رسوب ⭐⭐⭐
1. آنالیز منظم آب
اندازه گیری ماهانه یا فصلی پارامترهای:
- قلیاییت کل
- سختی کلسیم و منیزیم
- pH
- هدایت الکتریکی (EC)
2. استفاده از نرم کننده های آب (Water Softeners)
- جایگزینی یون های Ca² ⁺ و Mg² ⁺ با Na ⁺ از طریق رزینهای تبادل یونی.
3. تزریق مواد شیمیایی ضد رسوب
- پلیفسفاتها و پلیاکریلاتها جلوی کریستالشدگی ₃CaCO را میگیرند.
- اسیدهای ملایف (مثل اسید سیتریک) برای کاهش موقت pH و حل رسوبات موجود.
4. شستشوی شیمیایی دوره ای
- استفاده از رسوب بردارهای اسیدی برای پاکسازی سیستم های گردش آب.
- انجام تست های سازگاری قبل از شستشو برای جلوگیری از خوردگی.

درون مبدل حرارتی قبل از رسوب برداری

درون مبدل حرارتی بعد از شستشوی شیمیایی
❓❓❓ سوالات رایج کاربران ❓❓❓
❓ آیا قلیاییت بالا یعنی آب قلیایی است؟
خیر. قلیاییت (Alkalinity) ≠ pH .
- pH نشاندهنده غلظت یون H ⁺ است.
- قلیاییت نشاندهنده ظرفیت آب برای مقاومت در برابر تغییر pH است.
❓ آیا می توان بدون آزمایشگاه، قلیاییت را اندازه گیری کرد؟
بله، با کیتهای تیتراسیون میدانی (Field Test Kits) می توان تخمین اولیهای از قلیاییت کل گرفت، اما برای تشخیص دقیق کربنات و بی کربنات به تجهیزات آزمایشگاهی نیاز است.
❓ چه زمانی باید سیستم را شستشو کرد؟
- کاهش 10% در بازده حرارتی
- افزایش دمای خروجی آب
- افزایش فشار در پمپها
- گزارش های آنالیز آب نشان دهنده افزایش قلیاییت و سختی
✅ نتیجه گیری: سلامت سیستم های آبی، از آزمایش شروع می شود
درک و کنترل قلیاییت آب — بهویژه غلظت یون های کربنات و بی کربنات — نهتنها یک امر آزمایشگاهی، بلکه یک استراتژی اقتصادی برای صنایع است. با سرمایهگذاری کم در آنالیز آب و برنامهریزی هوشمند برای شستشوی شیمیایی، می توان از هزینه های سنگین تعمیرات، توقف تولید و مصرف انرژی جلوگیری کرد.
اگر در صنعت خود با مشکلات رسوب، کاهش بازده یا خوردگی مواجه هستید، مشاوره تخصصی و آزمایشهای دقیق آب اولین قدم برای راهحل پایدار است. بسیاری از واحدهای صنعتی با همکاری آزمایشگاههای معتبر، برنامههای نگهداری پیشگیرانهای را اجرا می کنند که عمر تجهیزات را چندین سال افزایش می دهد.
⏳ اقدام بعدی شما چیست؟
اگر این مقاله برایتان مفید بود، آن را با همکاران خود در بخش نگهداری یا بهرهبرداری به اشتراک بگذارید. همچنین می توانید برای دریافت راهنمای رایگان «چکلیست نگهداری سیستم های گردش آب» از طریق فرم تماس در سایت ما اقدام کنید.
☎️☎️☎️ تماس با متخصصان آبریزان ☎️☎️☎️
اشتراک گذاری :














دیدگاه خود را ارسال کنید
نشانی ایمیل شما منتشر نخواهد شد.