اهمیت اندازه گیری pH آب
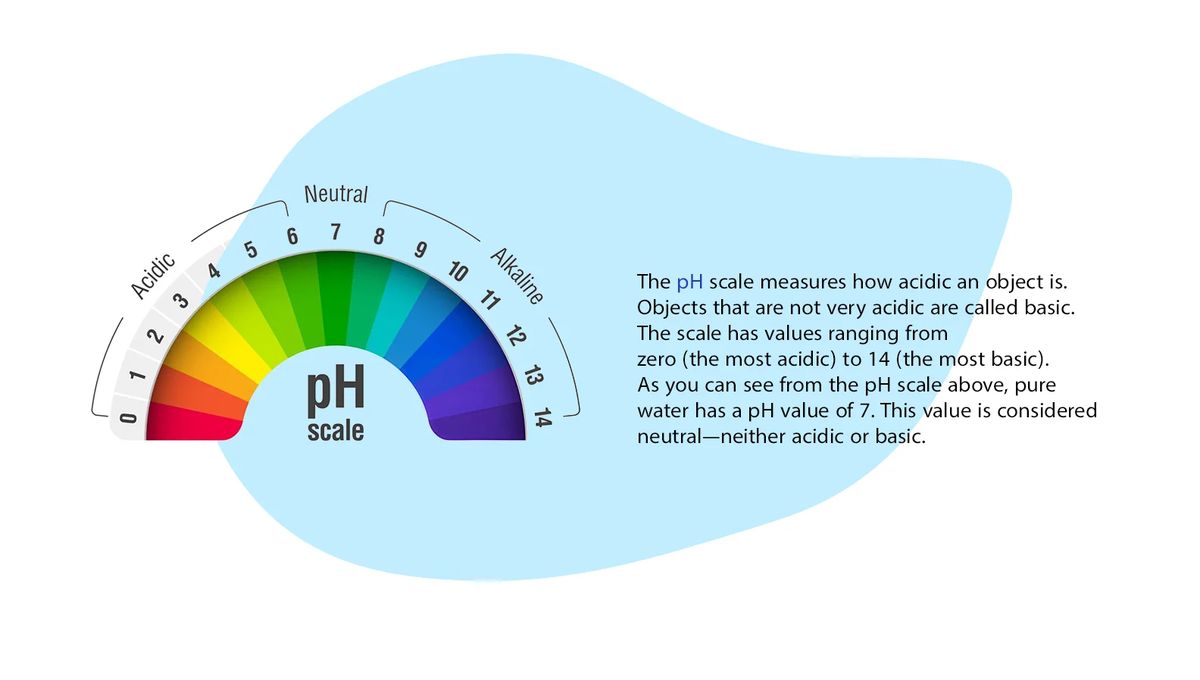
چرا اندازه گیری pH آب اهمیت زیادی دارد؟
اندازه گیری pH یکی از مهمترین و معمول ترین آزمایشات در شیمی آب است. تقریبا هر مرحله از تامین آب و تصفیه فاضلاب (به عنوان مثال، خنثی سازی اسید-باز، نرم سازی آب، ته نشینی، انعقاد، ضدعفونی کردن و کنترل خوردگی) به pH وابسته است. pH در اندازه گیری قلیائیت و دی اکسید کربن و بسیاری دیگر از تعادلات اسید و باز استفاده می شود. در دمای مشخصی، شدت فعالیت اسیدی یا بازی یک محلول با pH یا فعالیت یون هیدروژن نشان داده می شود. قلیائیت و اسیدیته، ظرفیت خنثی سازی اسید و باز موجود در آب هستند و معمولا به صورت میلی گرم کلسیم کربنات در لیتر بیان می شوند. ظرفیت بافر مقدار اسید یا باز قوی است (معمولا به صورت مول بر لیتر بیان می شود)، که مورد نیاز است برای اینکه مقدار PH یک نمونه ی 1 لیتری به مقدار 1 واحد تغییر کند. pH همانطور که توسط Sorenson1 تعریف شده است -log [H +] می باشد، که در واقع فاکتوری از “شدت” اسیدی بودن است. آب خالص به مقدار بسیار کمی یونیزه شده و در تعادل با محصولات یونی است.
((1))
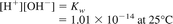
و
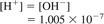
جایی که:
[H +] = فعالیت یونهای هیدروژن، مول / L
[OH-] = فعالیت یون های هیدروکسیل، مول / L و
Kw = محصول یونی آب.
به دلیل اثر متقابل و برهم کنش های یونی در تمام محلولهای بسیار رقیق شده، لازم است از “فعالیت” یون و نه غلظت مولی آن استفاده شود. در استفاده از اصطلاح pH فرض می شود که فعالیت یون هیدروژن،aH + در نظر گرفته شده. به دلیل هم ارزی تقریبی با مولاریته، به جای فعالیت از [H +] تنها در محلول های بسیار رقیق (قدرت یونی < 0.1 ) استفاده می شود.
مقیاس لگاریتمی برای بیان طیف گسترده ای از فعالیت های یونی مناسب است. معادله 1 در فرم لگاریتمی و اصلاح شده برای بازتاب فعالیت بیان شد:
((2))
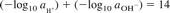
یا
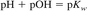
جایی که:
pH = log10 aH +
و
pOH = log10 aOH-.
میزان pH در دماهای مختلف چقدر است؟
معادله 2 بیان می کند که به دلیل افزایش pH ، pOH به طور معکوس کاهش می یابد و برعکس، به دلیل اینکهpKwدر دمای معین ثابت است. در دمای 25 درجه سانتیگراد،pH 7.0 خنثی است، فعالیت های هیدروژن و یون های هیدروکسیل برابر است و هر کدام به فعالیت تقریبی 10-7 مول / لیتر مطابق است. نقطه خنثی وابسته به دما است pH 7.5 در دمای 0 درجه سانتیگراد و pH 6.5 در دمای 60 درجه سانتیگراد pH خنثی می باشد.
مقدار pH محلول رقیق شده
مقدارpHیک محلول بسیار رقیق شده تقریبا برابر با لگاریتم منفی غلظت یون هیدروژن است. آبهای طبیعی معمولا دارای pH در محدوده 4 تا 9 هستند و اکثر آنها به دلیل حضور بی کربنات ها و کربنات های فلزات قلیایی و قلیایی خاکی، بازی هستند.
اشتراک گذاری :














دیدگاه خود را ارسال کنید
نشانی ایمیل شما منتشر نخواهد شد.