What is reverse osmosis and natural osmosis?

فرایند اسمز معکوس (Reverse Osmosis)
فرآیند اسمز معکوس یکی از شیوه های گسترده جداسازی است، که کاربردهای مختلفی دارد. شیرین سازی آب دریا، جداسازی مواد آلی و سمی از پساب های صنعتی دو مورد مهم استفاده از این تکنولوژی می باشد. اسمز معکوس یکی از روش های اصلی شیرین سازی آب در کنار روش هایی مانند تقطیر، الکترودیالیز، بدون یون سازی و … است که در مقیاس های آزمایشگاهی، شهری و صنعتی مورد استفاده قرار می گیرد.
تاریخچه کاربرد روش اسمز معکوس به سال های 1950 بر می گردد که آزمایش هایی توسط رید و برتون در دانشگاه فلوریدای آمریکا انجام پذیرفت و نخستین غشای اسمز معکوس از سلولز استات ساخته شد و در اواخر سال های 1960 این پدیده به صورت تجاری مورد استفاده قرار گرفت.
اصول نظری اسمز معکوس
شناخت پدیده اسمز معکوس نیازمند شناسایی خاصیت اسمزی است. به طور کلی انتقال جرم از یک محیط به محیط دیگر در اثر اختلاف غلظت و یا به عبارت بهتر در اثر اختلاف پتانسیل شیمیایی، به وجود می آید.
نحوه عملکرد اسمز معکوس
به عنوان مثال، ظرف آبی را در نظر بگیرید که یک قطعه بلور نمک طعام به درون آن انداخته می شود. در بخشی از ظرف که بلور نمک وجود دارد، غلظت نمک زیاد و غلظت آب ناچیز است و در بخش دیگر ظرف غلظت نمک صفر و غلظت آب بسیار زیاد است. در اثر اختلاف غلظت، مولکول های بلور نمک، نفوذ به بخش دیگر را که آب است، آغاز می نمایند و از سوی دیگر مولکول های آب نیز به بخش پر نمک نفوذ می کنند. این عمل تا یکسان شدن غلظت آب و نمک در دو بخش ادامه می یابد. چون بعد از آن نیروی محرکه که همان اختلاف غلظتی است بین دو محیط وجود ندارد و به بیان دیگر حالت تعادل برقرار گردیده است.
اسمز معکوس چیست؟
خاصیت اسمزی به عبور یک حلال از بخش محلول رقیق به بخش محلول غلیظ از درون یک غشا نیمه تراوا گفته می شود. برای تشریح این ویژگی، دو شکل زیر را درنظر بگیرید (اسمز طبیعی و اسمز معکوس) که نشان دهنده دو بخش و یک غشا می باشند. آب و یا محلول رقیق آب نمک در یک بخش، محلول غلیظ آب نمک در بخش دیگر و غشایی که تنها به مولکول های آب اجازه عبور می دهد. غشا از عبور یون های تشکیل دهنده نمک به دلیل بزرگ بودن جلوگیری می نماید.
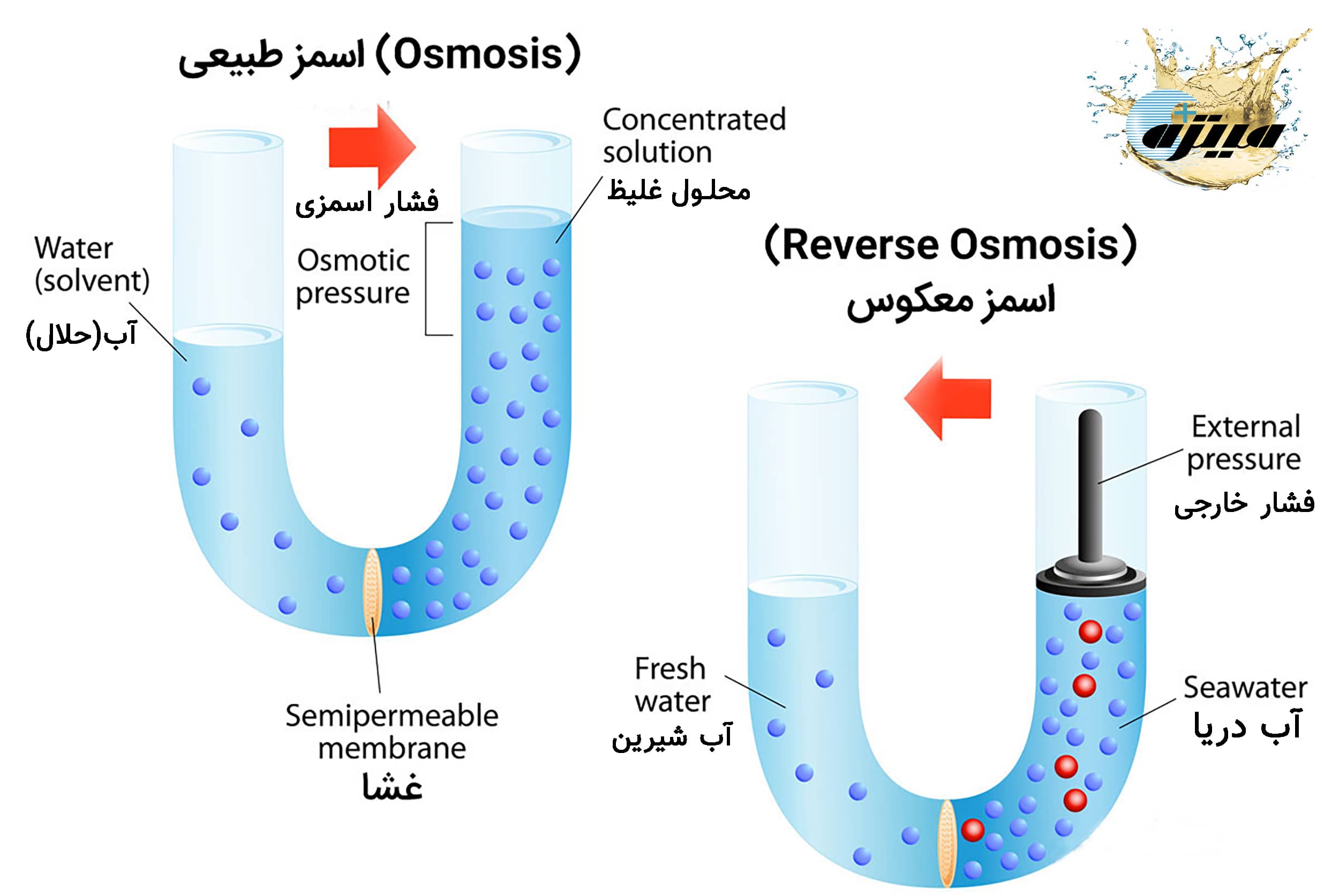
در ابتدا سطح مایعات در دو بخش مساوی می باشد. به دلیل وجود تمایل به یکسان نمودن غلظت ها در دو بخش، مولکول های آب از بخش محلول رقیق از غشا عبور نموده و به درون محلول غلیظ نفوذ می کنند. سطح مایع در بخش غلیظ افزایش می یابد(اسمز طبیعی). جریان مولکول های آب از درون غشا تا آنجا انجام می گیرد که اختلاف سطح مایع (به عبارت دیگر اختلاف فشار) در دو بخش مانع حرکت مولکول های آب شود. اختلاف فشار در بخش جدا شده توسط غشا که در آن از جریان خالص مولکول های آب جلوگیری می نماید، را فشار اسمزی می نامند.
فشار اسمزی سبب ایجاد تعادل در دو بخش می شود. حال چنانچه فشاری بیش از فشار اسمزی به بخش محلول غلیظ وارد شود، عکس پدیده اسمزی بروز می کند(اسمز معکوس)، به عبارت دیگر مولکول های آب از بخش محلول غلیظ تر به بخش محلول رقیق تر جریان می یابد. این پدیده را اسمز معکوس می نامند.
فشار اسمزی چیست؟
اختلاف فشار در بخش جدا شده توسط غشا که در آن از جریان خالص مولکول های آب جلوگیری می نماید، را فشار اسمزی می نامند.

کاربرد اسمز معکوس
از پدیده اسمز معکوس برای تصفیه آب و به عبارت کلی تر برای فرایند تغلیظ و جداسازی استفاده می شود. فشار اسمزی با غلظت املاح موجود در محلول نسبت مستقیم دارد. به عنوان مثال در محلول آبکی نمک طعام افزایش غلظت به مقدار هر میلی گرم در لیتر سبب زیاد شدن فشار اسمزی به میزان 0.01Psiمی شود. دقت شود که در اثر عبور مولکول های آب از غشا، غلظت یون های محلول پشت غشا به تدریج افزایش یافته و در نتیجه فشار اسمزی نیز زیاد می شود. همچنین به دلیل عبور آب از روی سطح غشا ذرات کلوئیدی، رسوبات، آلودگی های میکروبی و املاح محلول در آب ایجاد گرفتگی می کنند که نیاز است بصورت دوره ای عملیات شستشوی ممبران اسمز معکوس (CIP) انجام گردد. جهت حذف این آلودگی ها، می توانید از محلول های تخصصی شستشوی ممبران تولیدی شرکت آبریزان استفاده نمایید.
share :













Submit your opinion
Your email address will not be published.